Snabb platsriktad Mutagenesis Kit
Funktioner
■ Enkelt och snabbt: Satsen använder plasmidförstärkningsteknik utan strängbyte. Det behöver bara 4 steg för att förverkliga transformationen från vildtypsstam till mutantstam, utan de tidskrävande och arbetskrävande stegen, såsom flera PCR-rundor och subkloning.
■ Högeffektiv primer: Satsen antar principen om delvis överlappande primerdesign, så att fler mutanta plasmider kan erhållas genom amplifiering.
■ allmänt tillämpligt: Satsen kan inte bara utföra mutation på en plats, utan även mutation på flera platser. Den kan mutera upp till 5 platser.
■ Stark anpassningsförmåga: Satsen kan utföra platsriktad mutation på plasmider med en maximal storlek på 10 kb, som i princip täcker alla vanliga plasmider.
■ Hög mutationshastighet: satsen har funktionen av dubbel matsmältning av metylerade plasmidmallar in vitro och in vivo, vilket garanterar högre mutationshastighet.
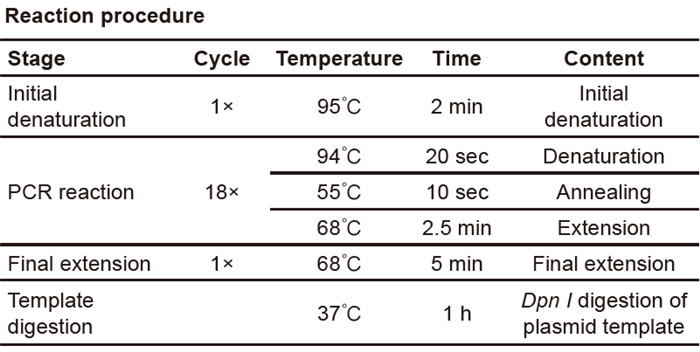
Site-Mutation Reaction Setup och PCR-program
■ För mutation med en enda primer med flera platser kommer mutationshastigheten att vara lägre än mutationen på en plats på grund av det ökade antalet mutationsställen. Enligt våra experimentella data, när antalet mutationsställen når 5, kommer den positiva mutationshastigheten att minska till 50%. Därför rekommenderas i detta fall att öka antalet verifierade kloner.
■ Kitet stöder multi-primer multi-site mutation, så att mutationsexperiment kan utföras samtidigt i ett bredare spektrum av gener. Den övre gränsen för antalet mutationsställen är fortfarande 5.
■ Det föreslås att kontrollplasmiderna och primrarna som medföljer i satsen bör appliceras vid nya mutationsexperiment för att underlätta analys av experimentella problem.

Alla produkter kan anpassas för ODM/OEM. För detaljer,vänligen klicka på Anpassad tjänst (ODM/OEM)
A-1 mall
■ Mallen innehåller proteinföroreningar eller Taq -hämmare etc. —— Rena DNA -mall, ta bort proteinföroreningar eller extrahera mall -DNA med reningskit.
■ Denatureringen av mallen är inte fullständig —— Lämpligt öka denatureringstemperaturen och förläng denatureringstiden.
■ Mallnedbrytning —— Förbered mallen igen.
A-2 Primer
■ Dålig kvalitet på primers —— Syntetisera primern igen.
■ Nedbrytning av primer —— Dela upp högkoncentrationsprimrarna i liten volym för bevarande. Undvik att frysa och tina flera gånger eller långvarig kryokonservering vid 4 ° C.
■ Felaktig design av primers (t.ex. primerlängd inte tillräcklig, dimer bildad mellan primers, etc.) -Design primers (undvik bildning av primer dimer och sekundär struktur)
A-3 mg2+koncentration
■ Mg2+ koncentrationen är för låg —— Rätt öka Mg2+ koncentration: Optimera Mg2+ koncentration genom en serie reaktioner från 1 mM till 3 mM med ett intervall på 0,5 mM för att bestämma den optimala Mg2+ koncentration för varje mall och primer.
A-4 Glödgningstemperatur
■ Den höga glödgningstemperaturen påverkar bindningen av primer och mall. —— Minska glödgningstemperaturen och optimera tillståndet med en lutning på 2 ° C.
A-5 Förlängningstid
■ Kort förlängningstid —— Öka förlängningstiden.
Fenomen: Negativa prover visar också målsekvensbanden.
A-1 kontaminering av PCR
■ Korsförorening av målsekvens eller förstärkningsprodukter —— Försiktigt att inte pipettera provet som innehåller målsekvensen i det negativa provet eller spill ut dem från centrifugröret. Reagensen eller utrustningen bör autoklaveras för att eliminera befintliga nukleinsyror, och förekomsten av kontaminering bör bestämmas genom negativa kontrollförsök.
■ Reagenskontaminering ——Använd reagenserna och förvara dem vid låg temperatur.
A-2 Primer
■ Mg2+ koncentrationen är för låg —— Rätt öka Mg2+ koncentration: Optimera Mg2+ koncentration genom en serie reaktioner från 1 mM till 3 mM med ett intervall på 0,5 mM för att bestämma den optimala Mg2+ koncentration för varje mall och primer.
■ Felaktig primerdesign och målsekvensen har homologi med icke-målsekvensen. —— Re-design primers.
Fenomen: PCR-förstärkningsbanden är oförenliga med den förväntade storleken, antingen stora eller små, eller ibland förekommer både specifika förstärkningsband och icke-specifika förstärkningsband.
A-1 Primer
■ Dålig primerspecificitet
—— Re-design primer.
■ Primerkoncentrationen är för hög —— Höj denatureringstemperaturen korrekt och förläng denatureringstiden.
A-2 mg2+ koncentration
■ Mg2+ koncentrationen är för hög ——Sänk korrekt Mg2+ -koncentrationen: Optimera Mg2+ koncentration genom en serie reaktioner från 1 mM till 3 mM med ett intervall på 0,5 mM för att bestämma den optimala Mg2+ koncentration för varje mall och primer.
A-3 termostabilt polymeras
■ Överdriven enzymmängd —— Minska enzymmängden på lämpligt sätt med intervallet 0,5 U.
A-4 Glödgningstemperatur
■ Glödgningstemperaturen är för låg —— Höj glödgningstemperaturen på lämpligt sätt eller använd tvåstegsglödgningsmetoden
A-5 PCR-cykler
■ För många PCR -cykler —— Minska antalet PCR -cykler.
A-1 Primer——Dålig specificitet ——Design primern, ändra primerns position och längd för att förbättra dess specificitet; eller utföra kapslad PCR.
A-2 Mall-DNA
——Mallen är inte ren —— Rena mallen eller extrahera DNA med reningssatser.
A-3 mg2+ koncentration
——Mg2+ koncentrationen är för hög —— Minska Mg korrekt2+ koncentration: Optimera Mg2+ koncentration genom en serie reaktioner från 1 mM till 3 mM med ett intervall på 0,5 mM för att bestämma den optimala Mg2+ koncentration för varje mall och primer.
A-4 dNTP
—— Koncentrationen av dNTP är för hög —— Minska koncentrationen av dNTP på lämpligt sätt
A-5 Glödgningstemperatur
—— För låg glödgningstemperatur —— Lämpligt öka glödgningstemperaturen
A-6 cykler
——För många cykler ——Optimera cykelnumret

Det första steget är att välja lämpligt polymeras. Vanligt Taq-polymeras kan inte korrekturläsas på grund av avsaknad av 3'-5'-exonukleasaktivitet, och felanpassning kommer att kraftigt minska förlängningseffektiviteten hos fragment. Därför kan vanligt Taq -polymeras inte effektivt amplifiera målfragment större än 5 kb. Taq -polymeras med speciell modifiering eller annat högfrekvent polymeras bör väljas för att förbättra förlängningseffektiviteten och uppfylla behoven för långfragmentförstärkning. Dessutom kräver amplifieringen av långa fragment också motsvarande justering av primerdesign, denatureringstid, förlängningstid, buffert-pH, etc. Vanligtvis kan primers med 18-24 bp leda till bättre utbyte. För att förhindra mallskador bör denatureringstiden vid 94 ° C reduceras till 30 sekunder eller mindre per cykel, och tiden för att stiga temperaturen till 94 ° C före förstärkning bör vara mindre än 1 min. Dessutom kan inställning av förlängningstemperaturen till cirka 68 ° C och utformning av förlängningstiden enligt hastigheten 1 kb/min säkerställa effektiv förstärkning av långa fragment.
Felhastigheten för PCR -amplifiering kan reduceras genom att använda olika DNA -polymeraser med hög trovärdighet. Bland alla Taq -DNA -polymeraser som hittills hittats har Pfu -enzymet lägsta felfrekvens och högsta trovärdighet (se bifogad tabell). Förutom enzymval kan forskare ytterligare minska PCR -mutationshastigheten genom att optimera reaktionsförhållandena, inklusive optimering av buffertkomposition, koncentration av termostabilt polymeras och optimering av PCR -cykelantal.
Produktkategorier
VARFÖR VÄLJA OSS
Sedan etableringen har vår fabrik utvecklat produkter i världsklass med principen
av kvalitet först. Våra produkter har fått ett utmärkt rykte i branschen och är värdefulla bland nya och gamla kunder.








