TIANSeq Fast DNA Library Kit (illumina)


Funktioner
- Bra enhetlighet för sekvensering: Ingen basförskjutning av DNA -fragmenteringsprocessen och PCR -amplifieringsprocessen.
- Hög bibliotekskonverteringseffektivitet: Högeffektiv bibliotekskonstruktion kan garanteras för så låga som 0,25 ng DNA-prover.
- Snabb drift: Hela förberedelseprocessen för biblioteket behöver bara 2 timmar.
Specifikation
Typ: Förberedelse av DNA-bibliotek för plattform med hög kapacitet för illumina.
Prov: cfDNA eller små DNA -fragment efter klippning genom ultraljuds- eller enzymatisk behandling.
Mål: Dubbelsträngat DNA.
Starta provinmatning: 0,25 ng- 1 μg.
Driftstid: 2-2,5 timmar.
Nedströms applikationer: Sekvensering på illumina plattform.
s
Alla produkter kan anpassas för ODM/OEM. För detaljer,vänligen klicka på Anpassad tjänst (ODM/OEM)

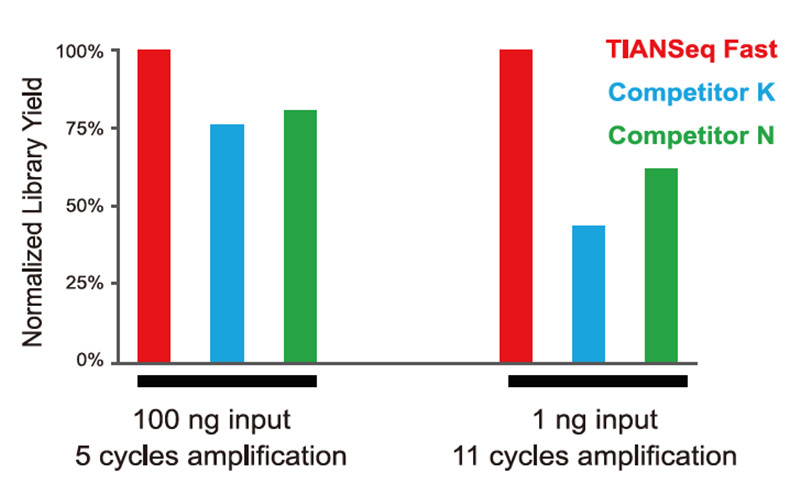 |
Jämförelse av bibliotekets konstruktionsavkastning Figur 1. Jämförelse av biblioteksutbytet mellan olika produkter |
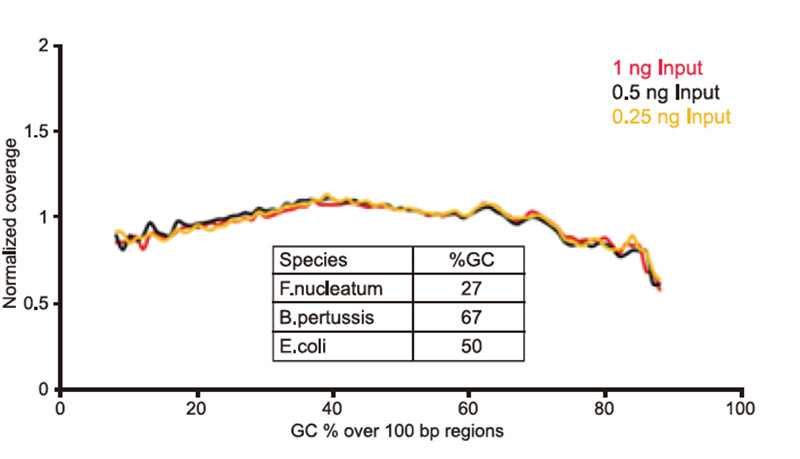 |
Genomtäckning av lågt inmatat DNA Figur 2. Genomtäckningsresultat för lågt inmatat DNA. Jämförelse av täckningshastigheter för olika DNA -ingångar (1,0,5,0,25 ng) av de tre bakteriella genomblandningarna med olika GC -innehåll i samma molförhållande. Resultaten visar att TIANSeq Fast DNA Library Kit garanterar god stabilitet och hög konverteringsfrekvens för konstruktion av spårprovbibliotek. |
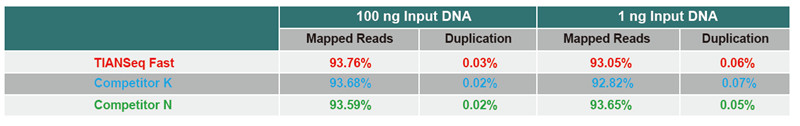 |
Jämförelse av sekvensdata för olika produkter |
För närvarande är högteknologisk sekvenseringsteknik huvudsakligen baserad på nästa generations sekvenseringsteknik. Eftersom läslängden för nästa generations sekvenseringsteknik är begränsad måste vi dela upp hela längdsekvensen i små fragmentbibliotek för att sekvensera. Enligt behoven hos olika sekvenseringsexperiment väljer vi vanligtvis enkelsekvensering eller dubbelsekvensering. För närvarande är DNA-fragmenten från nästa generations sekvensbibliotek i allmänhet fördelade i intervallet 200-800 bp.

a) DNA har dålig kvalitet och innehåller hämmare. Använd högkvalitativa DNA-prover för att undvika hämning av enzymaktivitet.
b) Mängden DNA-prov är otillräcklig när man använder PCR-fri metod för att konstruera DNA-bibliotek. När inmatningen av det fragmenterade DNA överstiger 50 ng kan PCR-fritt arbetsflöde utföras selektivt under bibliotekets konstruktionsprocess. Om bibliotekets kopieringsnummer är för lågt för att direkt sekvenseras kan DNA -biblioteket amplifieras med PCR efter adapterligeringen.
c) RNA -kontaminering leder till felaktig initial DNA -kvantifiering RNA -kontaminering kan förekomma i reningsprocessen för genomiskt DNA, vilket kan leda till felaktig DNA -kvantifiering och otillräcklig DNA -laddning under bibliotekets konstruktion. RNA kan avlägsnas genom behandling med RNas.
A-1
a) Små fragment (60 bp-120 bp) visas Små fragment är vanligtvis adapterfragment eller dimerer som bildas av adaptrar. Rening med Agencourt AMPure XP magnetpärlor kan effektivt ta bort dessa adapterfragment och säkerställa sekvenseringskvalitet.
b) Stora fragment visas i biblioteket efter PCR -amplifiering Storleken på bibliotekets DNA -fragment kommer att öka med 120 bp efter att adaptern ligerats. Om DNA -fragmentet ökar med mer än 120 bp efter adapterligeringen kan det orsakas av onormal fragmentförstärkning av överdriven PCR -amplifiering. Att minska antalet PCR -cykler kan förhindra situationen.
c) Onormal storlek på bibliotekets DNA -fragment efter adapterligering Längden på adaptern i detta kit är 60 bp. När fragmentets två ändar ligeras till adaptrarna kommer längden bara att öka med 120 bp. Om du använder en annan adapter än den som tillhandahålls av detta kit, vänligen kontakta leverantören för att ge relevant information, till exempel adapterlängd. Se till att experimentets arbetsflöde och drift följer stegen som beskrivs i manualen.
d) Onormal DNA -fragmentstorlek före adapterligering Orsaken till detta problem kan orsakas av felaktiga reaktionsförhållanden under DNA -fragmentering. Olika reaktionstider bör användas för olika DNA -ingångar. Om DNA-ingången är mer än 10 ng, rekommenderar vi att välja reaktionstiden på 12 minuter som starttid för optimering, och fragmentstorleken som produceras vid denna tidpunkt ligger huvudsakligen i intervallet 300-500 bp. Användare kan öka eller minska längden på DNA-fragment i 2-4 minuter enligt sina egna krav för att optimera DNA-fragmenten med önskad storlek.
A-2
a) Fragmenteringstiden är inte optimerad Om det fragmenterade DNA: t är för litet eller för stort, se riktlinjerna för val av fragmenteringstid i instruktionen för att bestämma reaktionstiden, och använd denna tidpunkt som en kontroll, lägg dessutom till en reaktionssystem för att förlänga eller förkorta 3 minuter för att göra en mer exakt justering av fragmenteringstiden.
A-3
Onormal storleksfördelning av DNA efter fragmenteringsbehandling
a) Felaktig upptiningsmetod för fragmenteringsreagens, eller så blandas inte reagenset helt efter upptining. Tina reagenset 5 × Fragmentation Enzyme Mix på is. Efter upptining blandar du reagenset jämnt genom att försiktigt slå på rörets botten. Virvela inte reagensen!
b) DNA -ingångsprovet innehåller EDTA eller andra föroreningar. Förtäring av saltjoner och kelatbildare i DNA -reningssteget är särskilt viktigt för experimentets framgång. Om DNA är upplöst i 1 × TE, använd metoden i instruktionen för att utföra fragmentering. Om EDTA -koncentrationen i lösningen är osäker rekommenderas att rena DNA: t och lösa det i avjoniserat vatten för efterföljande reaktion.
c) Felaktig initial DNA -kvantifiering Storleken på fragmenterat DNA är nära besläktat med mängden DNA -input. Innan fragmenteringsbehandling är noggrann kvantifiering av DNA med Qubit, Picogreen och andra metoder avgörande för att bestämma den exakta mängden DNA i reaktionssystemet.
d) Beredningen av reaktionssystemet följer inte instruktionerna Beredningen av fragmenterat reaktionssystem måste utföras på is strikt enligt instruktionerna. För att säkerställa bästa effekt bör alla reaktionskomponenter placeras på is och beredningen av reaktionssystemet utföras efter fullständig kylning. När beredningen är klar, snickra eller pipettera för att blanda noggrant. Vortexa inte!
1. Felaktig blandningsmetod (virvel, våldsam oscillation, etc.) kommer att orsaka onormal fördelning av biblioteksfragment (som visas i följande figur), vilket påverkar bibliotekets kvalitet. Därför, när du förbereder reaktionslösningen Fragmentation Mix, pipettera försiktigt upp och ner för att blanda, eller använd fingertoppen för att flicka och blanda jämnt. Var försiktig så att du inte blandar med virvel.

2. DNA med hög renhet måste användas för bibliotekskonstruktion
■ God DNA -integritet: Elektroforesbandet är mer än 30 kb, utan svans
■ OD260/230:> 1,5
■ OD260/280: 1,7-1,9
3. Mängden DNA -ingång måste vara korrekt Det föreslås att man använder Qubit och PicoGreen -metoder för att kvantifiera DNA, snarare än Nanodrop.
4. Innehållet av EDTA i DNA -lösning måste bestämmas EDTA har ett stort inflytande på fragmenteringsreaktionen. Om halten av EDTA är hög måste DNA -rening utföras före det efterföljande testet.
5. Fragmenteringsreaktionslösningen måste framställas på is. Fragmenteringsprocessen är känslig för reaktionstemperatur och tid (särskilt efter tillsats av förstärkare). För att säkerställa noggrannhet i reaktionstiden, förbered reaktionssystemet på is.
6. Fragmenteringens reaktionstid måste vara korrekt. Reaktionstiden för fragmenteringssteget kommer direkt att påverka storleken på fragmentprodukterna, vilket påverkar storleksfördelningen av DNA -fragment i biblioteket.
1. Vilken typ av prov gäller för detta kit?
Den tillämpliga provtypen för detta kit kan vara totalt RNA eller renat mRNA med god RNA -integritet. Om totalt RNA används för att konstruera biblioteket, rekommenderas att först använda rRNA -utarmningssatsen (Cat#4992363/4992364/4992391) för att ta bort rRNA.
2. Kan FFPE -prover användas för att konstruera bibliotek med detta kit?
MRNA i FFPE -prover kommer att brytas ned till en viss grad med relativt dålig integritet. När du använder detta kit för bibliotekets konstruktion rekommenderas att optimera fragmenteringstiden (förkorta fragmenteringstiden eller inte utföra fragmentering).
3. Vad kan orsaka att det infogade segmentet uppvisar en liten avvikelse med hjälp av steget för val av storlek i produktmanualen?
Storleksval ska utföras i strikt överensstämmelse med storleksvalsteget i denna produktmanual. Om det finns avvikelse kan orsaken vara att magnetpärlorna inte är balanserade till rumstemperatur eller inte är helt blandade, pipetten inte är korrekt eller att vätskan sitter kvar i spetsen. Det rekommenderas att använda tipsen med låg adsorption för experimentet.
4. Urval av adaptrar i bibliotekskonstruktion
Bibliotekets byggsats innehåller inte adapterreagens, och det rekommenderas att använda detta kit tillsammans med TIANSeq Single-Index Adapter (Illumina) (4992641/4992642/4992378).
5. QC för biblioteket
Bibliotekets kvantitativa detektion: Qubit och qPCR används för att bestämma masskoncentrationen respektive molarkoncentrationen för biblioteket. Operationen överensstämmer strikt med produktmanualen. Koncentrationen av biblioteket uppfyller i allmänhet kraven för NGS -sekvensering. Upptäckt av biblioteksdistributionsintervall: Användning av Agilent 2100 Bioanalyzer för att upptäcka biblioteksdistributionsområdet.
6. Val av amplifieringscykelnummer
Enligt instruktionerna är antalet PCR-cykler 6-12, och antalet PCR-cykler som behövs bör väljas enligt provinmatningen. I högavkastningsbibliotek sker överförstärkning vanligtvis i varierande grad, vilket manifesteras av en något större topp efter målintervallets topp vid detektering av Agilent 2100 Bioanalyzer, eller den detekterade koncentrationen av Qubit är lägre än för qPCR. Mild överförstärkning är ett normalt fenomen som inte påverkar bibliotekssekvensering och efterföljande dataanalys.
7. Spikar visas i detekteringsprofilen för Agilent 2100 Bioanalyzer
Spikernas utseende vid Agilent 2100 Bioanalyzer -detektering beror på den ojämna fragmenteringen av prover, där det kommer att finnas fler fragment i viss storlek, och detta kommer att bli mer uppenbart efter PCR -anrikning. I detta fall föreslås att man inte utför storleksvalet, dvs ställer fragmenteringstillståndet till 94 ° C i 15 minuter inkuberad, där fragmentfördelningen är liten och koncentrerad och homogeniteten kan förbättras.
Produktkategorier
VARFÖR VÄLJA OSS
Sedan etableringen har vår fabrik utvecklat produkter i världsklass med principen
av kvalitet först. Våra produkter har fått ett utmärkt rykte i branschen och är värdefulla bland nya och gamla kunder.










